แนะนำศูนย์เฝ้าระวังความปลอดภัยด้านผลิตภัณฑ์สุขภาพ (Health Product Vigilance Center)
| ความเป็นมา |
| ในปี พ.ศ. 2523 กระทรวงสาธารณสุขโดยสำนักงานคณะกรรมการอาหารและยาดำเนินโครงการนำร่องเพื่อศึกษาพัฒนารูปแบบการติดตามอาการไม่พึงประสงค์จากการใช้ยา และในปีพ.ศ.2526 กระทรวงสาธารณสุขได้จัดตั้งศูนย์ติดตามอาการอันไม่พึงประสงค์จากการใช้ยาขึ้น (Adverse Drug Reaction Monitoring Center: ADRMC) ภายใต้ความรับผิดชอบ ของสำนักงานคณะกรรมการอาหารและยา ทำหน้าที่ติดตามรวบรวมรายงานการเกิดอาการไม่พึงประสงค์จากการใช้ยา วิเคราะห์และประเมิน โดยอาศัยหลักการทางระบาดวิทยาและสถิติเพื่อให้ทราบถึงระดับความรุนแรง ขอบเขต และสาเหตุของปัญหาต่างๆและจัดทำเป็นรายงานเสนอต่อคณะกรรมการยาเพื่อหาทางแก้ปัญหาที่เกิดขึ้นและเผยแพร่ ข้อมูลให้ผู้ที่เกี่ยวข้องทราบเพื่อใช้ประโยชน์ ต่อมาในปี พ.ศ. 2527 ประเทศไทยได้สมัครเข้าร่วมเป็นประเทศสมาชิก ลำดับที่ 26 ของ WHO Programme for International Drug Monitoring เพื่อประสานการดำเนินงานดังกล่าว ในระดับนานาชาติ |
| ศูนย์ติดตามอาการอันไม่พึงประสงค์จากการใช้ยาได้พัฒนาระบบการเฝ้าระวังติดตามอาการไม่พึงประสงค์ จากการใช้ยาอย่างต่อเนื่องมาโดยตลอด โดยปี พ.ศ.2535 มีการจัดตั้งศูนย์ติดตามอาการอันไม่พึงประสงค์จากการ ใช้ยาระดับเขตในส่วนภูมิภาค ครอบคลุมโรงพยาบาลและสถานพยาบาลภาครัฐและเอกชนกว่า 1,000 แห่ง มีโรงพยาบาลระดับศูนย์เป็นแม่ข่ายในแต่ละเขต ทำหน้าที่ส่งเสริม สนับสนุนให้มีระบบเฝ้าระวังความปลอดภัย จากการใช้ยาขึ้นในโรงพยาบาลตลอดจนให้คำแนะนำด้านวิชาการแก่โรงพยาบาลต่างๆในเครือข่ายรูปแบบการเฝ้าระวัง ในโรงพยาบาลส่วนใหญ่เป็นการร่วมมือของทีมสหสาขาวิชาชีพ มีเภสัชกรเป็นแกนนำประสานงานระหว่างบุคลากร ทางการแพทย์ภายในโรงพยาบาลและรายงานอาการไม่พึงประสงค์จากการใช้ยาที่พบให้แก่ศูนย์ส่วนกลาง |
| ปี พ.ศ. 2540 ศูนย์ติดตามอาการอันไม่พึงประสงค์จากการใช้ยาได้ขยายขอบเขตงานครอบคลุมผลิตภัณฑ์สุขภาพ ในความรับผิดชอบของสำนักงานคณะกรรมการอาหารและยาทุกประเภท (ได้แก่ยาวัตถุเสพติดอาหารเครื่องสำอาง เครื่องมือแพทย์และวัตถุอันตรายที่ใช้ในบ้านเรือนและทางสาธารณสุข) และขยายงานสู่สถานบริการสาธารณสุขอื่นๆ เช่น ร้านขายยา โรงพยาบาลส่งเสริมสุขภาพตำบล เป็นต้น นอกจากนี้ยังส่งเสริมกิจกรรมด้านการป้องกันการเกิด อาการไม่พึงประสงค์ที่ป้องกันได้(preventable ADR) และการป้องกันการเกิดอาการดังกล่าวซ้ำซ้อนในรูปแบบ ของการสนับสนุนเอกสารวิชาการและวัสดุอุปกรณ์ต่างๆ |
| ในปี พ.ศ. 2551 มีการปรับเปลี่ยนชื่อศูนย์เป็นศูนย์เฝ้าระวังความปลอดภัยด้านผลิตภัณฑ์สุขภาพ (Health ProductVigilance Center: HPVC) เพื่อให้สอดคล้องกับการดำเนินงานของศูนย์ที่ไม่เพียงส่งเสริมให้มีการติดตาม อาการไม่พึงประสงค์ฯ เท่านั้น หากแต่ยังเฝ้าระวังข้อมูลความปลอดภัยจากแหล่งอื่นๆ รวมถึงการป้องกันอาการ ไม่พึงประสงค์และความเสี่ยงจากการใช้ยาที่อาจเกิดขึ้นอีกด้วย |
| ในปี พ.ศ. 2553 ได้มีการปรับปรุงเขตงานเฝ้าระวังความปลอดภัยฯในส่วนภูมิภาคใหม่เป็น 18 เขตตามเขตสุขภาพการดำเนินงานเป็นรูปแบบเครือข่ายประสาน ปรับปรุงรูปแบบการรายงานเป็น AE online reporting system |
| ในปี พ.ศ. 2555 ได้มีการปรับปรุงเครือข่ายการเฝ้าระวังความปลอดภัยฯ ในส่วนภูมิภาคใหม่โดยแบ่งเป็น 12 เขตเพื่อให้สอดคล้องกับการแบ่งเขตพื้นที่เครือข่ายบริการของกระทรวงสาธารณสุขและของสำนักงานหลักประกัน สุขภาพแห่งชาติและสนับสนุนให้ผู้ประกอบการรายงานความปลอดภัยฯ โดยจัดทำแนวทางสำหรับผู้ประกอบการ ในการายงานความปลอดภัยของผลิตภัณฑ์ยาและชีววัตถุภายหลังออกสู่ตลาด รวมทั้งขยายประเภทของการปัญหา ความปลอดภัยให้กว้างขึ้นและครอบคลุมปัญหาอื่นๆเช่น ความคลาดเคลื่อนทางยา (medication error) พฤติกรรมการใช้ผลิตภัณฑ์สุขภาพที่ไม่เหมาะสม ความบกพร่องของผลิตภัณฑ์ (product defect) และการใช้ยาไม่ได้ประสิทธิผล (lack of effect) เป็นต้น |
| ในปี พ.ศ. 2557 ศูนย์เฝ้าระวังความปลอดภัยด้านผลิตภัณฑ์สุขภาพได้ขยายขอบเขตการเฝ้าระวังความปลอดภัย และจัดการความเสี่ยงด้านเครื่องมือแพทย์เพิ่มเติม ตามประกาศกระทรวงสาธารณสุข เรื่อง หลักเกณฑ์วิธีการ และเงื่อนไขการจัดทำรายงานผลการทำงานอันผิดปกติของเครื่องมือแพทย์หรือผลอันไม่พึงประสงค์ที่เกิดขึ้นกับ ผู้บริโภค และรายงานการดำเนินการแก้ไข และแนวทางการรายงานฯ |
| บทบาทหน้าที่ |
| การเฝ้าระวังความปลอดภัยด้านผลิตภัณฑ์สุขภาพ เป็นหนึ่งในภารกิจที่สำคัญของสำนักงานคณะกรรมการอาหารและยาในการกำกับดูแลผลิตภัณฑ์สุขภาพ โดยเฉพาะภายหลังผลิตภัณฑ์ออกสู่ตลาด การดำเนินงานดังกล่าวอยู่ภายใต้ความรับผิดชอบของศูนย์เฝ้าระวังความปลอดภัยด้านผลิตภัณฑ์สุขภาพ (Health Product Vigilance Center: HPVC) ซึ่งมีบทบาทหน้าที่สำคัญ คือ |
| (1) ศึกษาวิจัย พัฒนาและส่งเสริมระบบการเฝ้าระวังความปลอดภัยจากการใช้ผลิตภัณฑ์สุขภาพให้มีความเข้มแข็งและยั่งยืน (2) เป็นศูนย์เฝ้าระวังความปลอดภัยด้านผลิตภัณฑ์สุขภาพระดับชาติ บริหารจัดการฐานข้อมูลรายงานเหตุการณ์ไม่พึงประสงค์จากการใช้ผลิตภัณฑ์สุขภาพของประเทศไทย (Thai Vigibase) และดำเนินการร่วมกับเครือข่ายงานเฝ้าระวังความปลอดภัยทั้งภายในประเทศและต่างประเทศ (3) ตรวจจับและประเมินสัญญาณความเสี่ยง (signal detection and assessment) จากการใช้ผลิตภัณฑ์สุขภาพ ประเมินประโยชน์/ความเสี่ยงของผลิตภัณฑ์สุขภาพอ้างอิงตามหลักฐานทางวิชาการพร้อมเสนอมาตรการจัดการความเสี่ยงที่พบต่อคณะกรรมการ/หน่วยงานที่เกี่ยวข้อง (4) สอบสวนทางระบาดวิทยา วิเคราะห์ ประเมินเพื่อบริหารจัดการความเสี่ยง/อันตรายจากการใช้ผลิตภัณฑ์สุขภาพ (5) แลกเปลี่ยนข้อมูลข่าวสารกับองค์กรด้านสาธารณสุขอื่นๆ ที่เกี่ยวข้องทั้งในและต่างประเทศ เพื่อพัฒนาเครือข่ายการเฝ้าระวังความปลอดภัยที่มีประสิทธิภาพและประสิทธิผล (6) สื่อสารข้อมูลเกี่ยวกับความปลอดภัยด้านผลิตภัณฑ์สุขภาพให้แก่บุคลากรทางการแพทย์และผู้ที่สนใจผ่านสื่อต่างๆ |
| รายงานเหตุการณ์ไม่พึงประสงค์จากการใช้ผลิตภัณฑ์สุขภาพในมนุษย์ |
| ศูนย์เฝ้าระวังความปลอดภัยด้านผลิตภัณฑ์สุขภาพ ได้รับรายงานเหตุการณ์ไม่พึงประสงค์จากการใช้ผลิตภัณฑ์สุขภาพยาและวัตถุเสพติดในฐานข้อมูล Thai Vigibase ตั้งแต่ปี พ.ศ. 2527 และสามารถนำมาวิเคราะห์ได้รวมทั้งสิ้น 834,854 ฉบับ (ข้อมูล ณ วันที่ 17 ตุลาคม พ.ศ. 2562) (แผนภาพที่ 1) |
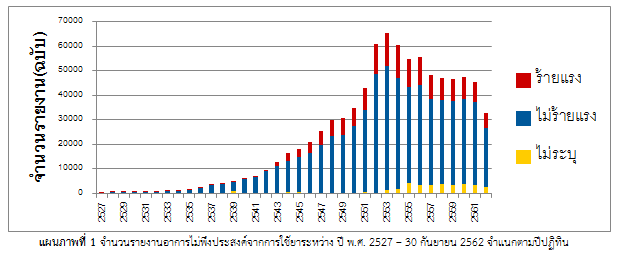 |
|
HPVC ได้ส่งรายงานอาการไม่พึงประสงค์จากการใช้ยา (Adverse Drug Reaction: ADR) ให้องค์การอนามัยโลกอย่างต่อเนื่อง ประมาณปีละ
30,000 – 40,000 ฉบับ ในปี พ.ศ. 2562 ประเทศไทยได้รับการจัดอันดับคุณภาพของรายงานที่คะแนน 0.74 คะแนน จากคะแนนเต็ม 1 |
| การบริหารจัดการ |
| การบริหารจัดการงานเฝ้าระวังความปลอดภัยด้านผลิตภัณฑ์สุขภาพ มีลักษณะเป็นรูปแบบเครือข่ายประกอบด้วยสถานพยาบาลทั้งภาครัฐและภาคเอกชน ครอบคลุมทั่วประเทศทุกระดับ ตั้งแต่ระดับปฐมภูมิจนถึงระดับตติยภูมิที่มากกว่า1,000แห่ง นอกจากนี้ยังมีเครือข่ายที่เป็นผู้ประกอบการและร้านยาเครือข่ายเหล่านี้จะทำหน้าที่เฝ้าระวังเหตุการณ์ไม่พึงประสงค์และส่งรายงานมายังศูนย์ HPVC |
| วิธีการเฝ้าระวังความปลอดภัยด้านยา (Pharmacovigilance Method) |
| 1. Spontaneous Reporting |
| เป็นวิธีการหลักของระบบการเฝ้าระวังทั่วโลกรวมถึงประเทศไทย เป็นวิธีการที่บุคลากรทางการแพทย์หรือผู้ประกอบการ ส่งรายงานเหตุการณ์ไม่พึงประสงค์ที่เกิดขึ้นกับผู้ป่วยตามแบบฟอร์มที่กำหนดไปยังศูนย์HPVC เป็นวิธีที่ใช้ในการเฝ้าระวังผลิตภัณฑ์ทุกชนิดจุดเด่น คือดำเนินการได้ง่าย ค่าใช้จ่ายน้อย สามารถตรวจพบความเสี่ยงที่เกิดขึ้นน้อย เพราะโดยหลักการแล้วเป็นวิธีการเฝ้าระวังที่ครอบคลุมผลิตภัณฑ์และเหตุการณ์ไม่พึงประสงค์ทุกชนิด แต่ในทางปฏิบัติกลับพบปัญหาจำนวนรายงาน ADRs ในระดับที่ต่ำกว่าความเป็นจริง (under-reporting) |
| 2. Intensified (Stimulated) Reporting |
| เป็นวิธีการเฝ้าระวังแบบ spontaneous reporting แต่มีการดำเนินการกิจกรรมบางอย่างเพิ่มเติม เพื่อกระตุ้นหรืออำนวยความสะดวกในการรายงานผลิตภัณฑ์ใหม่ที่เริ่มจำหน่ายในตลาด ตัวอย่างวิธีการนี้ที่รู้จักกันโดยทั่วไป คือ Early Post-Marketing Phase Vigilance (EPPV) ของประเทศญี่ปุ่นสำหรับประเทศไทยคือการเฝ้าระวังความปลอดภัยของยาใหม่ที่ได้รับอนุมัติทะเบียนตำรับยาแบบมีเงื่อนไขที่กำหนดให้ผู้ประกอบการต้องติดตามความปลอดภัยของยา(Safety Monitoring Program ;SMP) เป็นระยะเวลา2 ปีและการรายงานเหตุการณ์ไม่พึงประสงค์จากการใช้ยาดังกล่าวเป็นหนึ่งในเงื่อนไขของ SMP ในกรณีที่มีข้อมูลความปลอดภัยไม่เพียงพอหรือมีประเด็นด้านความปลอดภัย ยาดังกล่าวอาจติดตามความปลอดภัยต่อเนื่องจนกว่าจะมีข้อมูลเพียงพอที่จะได้รับอนุมัติทะเบียนแบบไม่มีเงื่อนไขวิธีการเฝ้าระวังก็จะถูกปรับเปลี่ยนเป็น spontaneous reporting |
| 3. Targeted Spontaneous Reporting |
| เป็นวิธีการเฝ้าระวังแบบ spontaneous reporting ที่มีการกำหนดกลุ่มเป้าหมาย (ยาหรือผู้ป่วย) และ/หรือความเสี่ยงที่สนใจ มีชุดคำถามที่ครอบคลุมทุกประเด็นของความเสี่ยง เก็บข้อมูลเฉพาะความเสี่ยงที่สนใจ ข้อดีคือ สามารถประเมินความเสี่ยงในเชิงปริมาณด้วยการคำนวณอุบัติการณ์หรืออัตรารายงานได้เพราะทราบจำนวนผู้ป่วย วิธีการนี้มีการประยุกต์ใช้เฝ้าระวังผู้ป่วยกลุ่มเสี่ยง ยาที่ใช้ในงานสาธารณสุข(public health program)ผ่านคลินิกเฉพาะโรคเช่น คลินิกผู้ป่วยวัณโรคคลินิกโรคเอดส์ คลินิกวาร์ฟาริน |
| 4. Cohort Event Monitoring |
| เป็นการเฝ้าระวังเชิงรุกเป็นการศึกษาวิจัยทางระบาดวิทยาทางยาด้วยการสังเกตการณ์การเกิดเหตุการณ์ไม่พึงประสงค์ที่สงสัยว่าสัมพันธ์กับการใช้ยาหนึ่งรายการหรือมากกว่า แบบติดตามไปข้างหน้าภายในระยะเวลาที่กำหนด ผู้ป่วยกลุ่มเป้าหมายทุกรายในกลุ่มจะถูกสัมภาษณ์ทั้งก่อนและหลังการรักษา เพื่อเก็บข้อมูลที่เกี่ยวข้องและเหตุการณ์ไม่พึงประสงค์ทุกชนิด ตามแบบสอบถามที่กำหนดประเทศไทยได้นำมาประยุกต์ใช้กับผู้ป่วยกลุ่มเสี่ยงที่ใช้ยาที่สนใจ วิธีนี้ในประเทศรู้จักกันภายใต้ชื่อ “การติดตามอย่างใกล้ชิด Intensive Monitoring Program (IMP)” ตัวอย่างเช่น โครงการเฝ้าระวังการใช้วัคซีนไข้หวัดใหญ่ (H1N1) แบบใกล้ชิดในบุคลากรทางการแพทย์ใน 4 จังหวัด ที่คัดเลือก โครงการเฝ้าระวังติดตามอาการไม่พึงประสงค์จากการใช้ยาพัฒนาจากสมุนไพรตามบัญชียาหลักแห่งชาติพ.ศ. 2542 |
| 5. การลงทะเบียนผู้ป่วย (Registry) |
| ในประเทศไทย มีการลงทะเบียนผู้ป่วยเพื่อเฝ้าระวังความปลอดภัยจากการใช้ยาในปีพ.ศ. 2551 ตามโครงการ “A Prospective, Immunogenicity Surveillance Registry of ESA with Subcutaneous Exposure in Thailand” เนื่องจากการเพิ่มขึ้นของจำนวนผู้ป่วยที่เกิดภาวะโลหิตจางอย่างรุนแรงชนิด pure red cell aplasia (PRCA) ในผู้ป่วยโรคไตเรื้อรังที่ใช้ยา erythropoiesis stimulating agents (ESAs) |
| บรรณานุกรม |
| 1. ศูนย์เฝ้าระวังความปลอดภัยด้านผลิตภัณฑ์สุขภาพ. สรุปรายงานอาการไม่พึงประสงค์จากการใช้ยา ประจำปี 2560. พิมพ์ครั้งที่ 1. กรุงเทพ: สำนักพิมพ์อักษรกราฟฟิคแอนด์ดีไซน์; 2561. |
| 2. ปฐม สวรรค์ปัญญาเลิศ, วิมล สุวรรณเกษาวงษ์. ระบบเฝ้าระวังความปลอดภัยด้านผลิตภัณฑ์สุขภาพประเทศไทย Health Product Vigilance System in Thailand. พิมพ์ครั้งที่ 1. นนทบุรี: โรงพิมพ์สำนักงานพระพุทธศาสนาแห่งชาติ; 2559. |